User:GrosMocassin/sandbox
| This is not a Wikipedia article: It is an individual user's work-in-progress page, and may be incomplete and/or unreliable. For guidance on developing this draft, see Wikipedia:So you made a userspace draft. Find sources: Google (books · news · scholar · free images · WP refs) · FENS · JSTOR · TWL |

Chez les humains, la douleur est un sentiment pénible souvent causée par des stimuli intenses ou nuisibles. Le fait que d'autres animaux que l'homme subissent aussi la douleur est controversé. La manière standard de mesurer la douleur chez l'homme consiste à demander à la personne de quantifier cette douleur, (sur une échelle d'évaluation de la douleur par exemple). La "Douleur" est définie par l'International Association for the Study of Pain comme "une expérience sensorielle et émotionnelle désagréable associée à une lésion tissulaire réelle ou potentielle, ou décrite en termes d'un tel dommage."[1] Seule la personne en proie à la douleur peut savoir la qualité et l'intensité de la douleur, et le degré de souffrance. Toutefois, pour les animaux non-humains, ils est plus difficile, voire même impossible de savoir si une expérience émotionnelle a eu lieu.[2] Par conséquent, ce concept est souvent exclu dans les définitions de la douleur chez les animaux, comme dans celle fournie par Zimmerman: "Une expérience sensorielle désagréable causée par une blessure réelle ou potentielle qui provoque des réactions végétatives et motrices de protection, ayant pour résultat l'évitement appris et pouvant modifier le comportement spécifique de l'espèce, y compris le comportement social."[3] Les animaux non-humains ne peuvent pas communiquer leurs ressentis comme le ferait un humain grâce au langage, mais l'observation de leur comportement fournit une indication raisonnable quant à l'étendue de leur douleur. Tout comme des médecins ou des infirmiers qui ne partageraient pas de langue commune avec un patient étranger, les indicateurs de la douleur peuvent encore être compris. Selon le Comité du Conseil national de recherches des États-Unis sur la reconnaissance et la réduction de la douleur chez les animaux de laboratoire, la douleur est vécue par de nombreuses espèces animales, y compris les mammifères et peut-être tous les vertébrés.[4]
L'expérience de la douleur[edit]
Bien qu'il existe de nombreuses définitions de la douleur, la quasi-totalité implique deux éléments clefs. Tout d'abord, la nociception est nécessaire.[5] C'est la capacité de détecter des stimuli nocifs qui suscitent une réponse réflexe qui déplace rapidement l'ensemble de l'animal, ou la partie affectée de son corps, à l'écart de la source du stimulus. Le concept de nociception n'implique aucun "ressenti" négatif ou subjectif - c'est une action réflexe. Un exemple chez l'homme serait le retrait rapide d'un doigt qui a touché quelque chose de chaud - le retrait se produit avant que toute sensation de douleur soit ressentie.
La deuxième composante est l'expérience de la «douleur» elle-même, ou la souffrance - l'interprétation interne, émotionnelle de l'expérience nociceptive. Encore une fois chez l'homme, c'est lorsque le doigt retiré commence à faire du mal, quelques instants après le retrait. La douleur est donc une expérience émotionnelle intime. La douleur ne peut pas être mesurée directement chez d'autres animaux, y compris d'autres humains : les réponses à des stimuli supposés douloureux peuvent être mesurées, mais pas l'expérience elle-même. Pour résoudre ce problème lors de l'évaluation de la capacité des autres espèces à ressentir la douleur, on raisonne par analogie. On part du principe que si l'animal répond à un stimulus d'une manière similaire à la notre, il est susceptible d'avoir eu une expérience analogue.
La Nociception[edit]
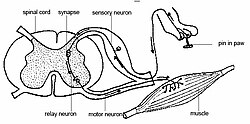
La nociception implique habituellement la transmission d'un signal le long d'une chaîne de fibres nerveuses à partir du site d'un stimulus nociceptif à la périphérie de la moelle épinière et du cerveau. Ce processus suscite une réponse de l'arc réflexe générée à la moelle épinière et n'impliquant pas le cerveau : faire un faux pas (broncher) ou retirer un membre. La nociception se retrouve, sous une forme ou une autre, chez tous les principaux taxons animaux.[5] La nociception peut être observée en utilisant des techniques modernes d'imagerie, une réponse physiologique et comportementale à la nociception peut être détectée.
La douleur[edit]
Les impulsions nerveuses de la réponse de la nociception peuvent remonter au cerveau qui enregistre ainsi l'emplacement, l'intensité, la qualité et le caractère désagréable du stimulus. Cette composante subjective de la douleur implique la conscience de la sensation et du désagrément (affect négatif). Les processus cérébraux sous-jacents dans prise de conscience de la sensation désagréable (souffrance), ne sont pas encore bien comprises.
Valeur sélective[edit]
La valeur sélective de la nociception est évidente : la détection d'un stimulus nociceptif permet à un organisme de éloigner immédiatement le membre, l'appendice ou le corps entier du stimulus nociceptif et ainsi d'éviter d'autres blessures (potentielles). Cependant, une caractéristique de la douleur (chez les mammifères au moins) est que la douleur peut entraîner une hyperalgésie (une sensibilité accrue à des stimuli nocifs) et l'allodynie (une sensibilité accrue à des stimuli non nocifs). Lorsque cette sensibilisation accrue se produit, la valeur sélective est moins claire. D’abord parce que la douleur résultant de la sensibilisation accrue peut être disproportionné par rapport à la détérioration des tissus réellement provoquée par le stimulus nocif. Ensuite parce que la sensibilisation accrue peut aussi devenir chronique, persistant au-delà de la guérison des tissus. Ainsi, la douleur n'est plus causée par les lésions tissulaires réelles, et c'est la douleur due à la sensibilisation accrue qui devient la préoccupation. Cela signifie que le processus de sensibilisation est parfois qualifiée d'inadapté. Il est souvent suggéré que l'hyperalgésie et l'allodynie aident les organismes à se protéger pendant la guérison, mais les preuves expérimentales font défaut.[6][7]
En 2014, la valeur sélective de la sensibilisation en raison de blessures a été testé en utilisant les interactions de prédation entre le calmar totam (Doryteuthis pealeii) et les black sea bass (Centropristis striata) qui sont des prédateurs naturels de ce calmar. Si des calmars blessés sont pourchassés par une bass, ils commencent leurs comportements défensifs plus tôt (indiqués par de plus grandes distances d'alerte et de plus longues distances d'initialisation de vol) que les calmars indemnes. Si un anesthésique (1% d'éthanol et MgCl2) est administré avant la lésion, cela empêche la sensibilisation et bloque l'effet du comportement. Les auteurs affirment que cette étude est la première preuve expérimentale pour soutenir l'argument selon lequel la sensibilisation nociceptive est en fait une réponse adaptative à des blessures.[8]
Raisonnement par analogie[edit]
Pour évaluer de la capacité des autres espèces à souffrir, nous avons recours au raisonnement par analogie. On suppose que si l'animal répond à un stimulus d'une manière similaire à la nôtre, il est susceptible d'avoir eu une expérience analogue. Si on pique le doigt d'un chimpanzé avec une épingle, il retire rapidement sa main. On en déduit que comme nous, elle a ressenti une douleur. Pour être cohérents, il faudrait aussi inférer qu'un cafard éprouve la même chose quand il se tord après avoir été piqué avec une épingle.[9] Comme l'homme, lorsqu'ils ont le choix des aliments, des rats[10] et des poulets[11] ayant des symptômes cliniques de la douleur vont consommer plus d'un aliment contenant un analgésique que les animaux ne souffrant pas. En outre, la consommation de l'analgésique (le carprofène) chez les poulets de chair boiteux est positivement corrélée à la gravité de la boiterie, et la consommation a entraîné une amélioration de la démarche. Les réactions physiques ne permettent pas toujours de déterminer les états mentaux (les réactions physiques ne sont d'ailleurs pas toujours liées à des états mentaux). C'est une Limite du raisonnement par analogie. Cette approche est aussi soumise à la critique de l'interprétation anthropomorphique : un organisme unicellulaire tel qu'un amibe peut se tordre après avoir été exposée à des stimuli nocifs, malgré l'absence de nociception.
Histoire[edit]
L'idée que les animaux pourraient ne pas éprouver de douleur ou des souffrances que les humains ne traces remontent au moins au philosophe français du 17e siècle, René Descartes, qui a soutenu que les animaux manquent de conscience. [12] [13] [14] Les chercheurs sont restés incertains dans les années 1980 quant à savoir si les animaux éprouvent de la douleur, et les vétérinaires formés aux États-Unis avant 1989 ont été tout simplement appris à ignorer la douleur animale. [15] dans ses interactions avec les scientifiques et autres vétérinaires, Bernard Rollin a été régulièrement invité à «prouver» que les animaux sont conscients, et de fournir des motifs «scientifiquement acceptables» prétend qu'ils ressentent de la douleur. [15] Certains auteurs disent que le point de vue que les animaux ressentent la douleur différemment est maintenant une opinion minoritaire. [12] revues académiques du sujet sont plus équivoques, en notant que, bien que il est probable que certains animaux ont au moins simples pensées et sentiments conscients, [16] certains auteurs continuent de se demander comment fiable animaux états mentaux peut être déterminé. [13] [17]
The idea that animals might not experience pain or suffering as humans do traces back at least to the 17th-century French philosopher, René Descartes, who argued that animals lack consciousness.[12][13][14] Researchers remained unsure into the 1980s as to whether animals experience pain, and veterinarians trained in the U.S. before 1989 were simply taught to ignore animal pain.[15] In his interactions with scientists and other veterinarians, Bernard Rollin was regularly asked to "prove" that animals are conscious, and to provide "scientifically acceptable" grounds for claiming that they feel pain.[15] Some authors say that the view that animals feel pain differently is now a minority view.[12] Academic reviews of the topic are more equivocal, noting that, although it is likely that some animals have at least simple conscious thoughts and feelings,[16] some authors continue to question how reliably animal mental states can be determined.[13][17]
In different species[edit]
The ability to experience pain in an animal, or another human for that matter, cannot be determined directly but it may be inferred through analogous physiological and behavioral reactions.[18] Although many animals share similar mechanisms of pain detection to those of humans, have similar areas of the brain involved in processing pain, and show similar pain behaviours, it is notoriously difficult to assess how animals actually experience pain.[19]
Nociception[edit]
Nociceptive nerves, which preferentially detect (potential) injury-causing stimuli, have been identified in a variety of animals, including invertebrates. The medicinal leech, Hirudo medicinalis, and sea slug are classic model systems for studying nociception.[19] Many other vertebrate and invertebrate animals also show nociceptive reflex responses similar to our own.
Douleur[edit]
De nombreux animaux présentent également des changements comportementaux et physiologiques plus complexes indiquant la capacité à éprouver de la douleur : ils mangent moins de nourriture, leur comportement normal est perturbé, leur comportement social est supprimé, ils peuvent adopter des comportements inhabituels, ils peuvent émettre des appels de détresse caractéristiques, éprouver des changements respiratoires et cardiovasculaires, des inflammations ou libérer des hormones de stress.[19] Certains critères qui peuvent indiquer le potentiel d'autres espèce à ressentir la douleur incluent:[20]
- Avoir système nerveux et des récepteurs sensoriels appropriés
- Manifester des changements physiologiques à des stimuli nocifs
- Afficher des réactions motrices de protection qui pourraient inclure l'utilisation réduite d'une zone affectée (boiter, masser, retenir or l'Autotomie)
- Avoir des récepteurs d'opioïdes and montrer des réponses réduites à des stimuli nocifs lorsqu'un analgésique est administré ou lors d'une anesthésie locale
- Montrer un compromis entre l'évitement d'un stimulus et d'autres exigences motivationnelles.
- Montrer un apprentissage d'évitement
- Grande capacité cognitive et sentience
Vertébrés[edit]
Poissons[edit]
Un nerf cutané typique de poisson contient 83% de fibres nerveuses du Groupe C (récepteurs de traumatisme : le type responsable de la transmission des signaux décrits par les humains comme une douleur atroce); les mêmes nerfs chez l'homme avec insensibilité congénitale à la douleur ont seulement 24-28% des récepteurs de type C.[21] La truite arc-en-ciel a environ 5% de fibres de type C, tandis que les requins et les raies en ont 0%.[22] Néanmoins, il a été montré que les poissons ont des neurones sensoriels qui sont sensibles à des stimuli nocifs et sont physiologiquement identiques aux nocicepteurs humains.[23] Les réponses comportementales et physiologiques à un événement douloureux semblent comparables à ceux observés chez les amphibiens, les oiseaux et les mammifères, et l'administration d'un médicament analgésique réduit ces réponses chez les poissons.[24]
les défenseurs de la protection des animaux ont fait part de leur inquiétude au sujet de la souffrance possible des poissons causées par la pêche. Certains pays, par exemple Allemagne, ont interdit certains types de pêche, et les Britanniques RSPCA poursuivent maintenant formellement les individus qui sont cruels envers les poissons.[25]
Invertébrés[edit]
Bien qu'il ait été soutenu que la plupart des invertébrés ne se ressentent pas la douleur,[26][27][28] il y a des preuves que les invertébrés, en particulier les crustacés décapodes (par exemple, les crabes et les homards) et les céphalopodes (par exemple les poulpes), présentent des réactions comportementale et physiologique indiquant qu'ils peuvent avoir la capacité de cette expérience.[9][29][30] Des nocicepteurs ont été trouvés chez les nématode, les annélide et les mollusques.[31] la plupart des insectes ne possèdent pas nocicepteurs,[32][33][34] une exception connue étant la Drosophila melanogaster.[35] Chez les vertébrés, les opioïdes endogènes sont des substances neurochimiques qui modèrent la douleur en interagissant avec les récepteurs opiacés. Les peptides opioïdes et les récepteurs opiacés sont naturellement présents chez les nématodes,[36][37] les mollusques,[38][39] les insectes[40][41] et les crustacés.[42][43] La présence d'opioïdes chez les crustacés a été interprétée comme une indication que les homards peuvent être en mesure d'éprouver de la douleur,[44] bien qu'il ait été revendiqué qu'"à l'heure actuelle aucune conclusion certaine ne peut être tirée".[44]
Une raison suggérée pour rejeter une expérience de la douleur chez les invertébrés est que le cerveau des invertébrés est trop petit. Cependant, la taille du cerveau ne correspond pas nécessairement à la complexité de sa fonction.[45] De plus, par rapport au poids corporel, le cerveau des céphalopodes est dans la même tranche de taille que le cerveau des vertébrés, plus petit que celui des oiseaux et des mammifères, mais aussi grand que ou plus grand que la plupart des cerveaux de poissons.[46][47]
Depuis Septembre 2010, tous les céphalopodes utilisés à des fins scientifiques dans l'UE sont protégés par la directive 2010 de l'UE/63/UE qui stipule que «... il existe des preuves scientifiques de leur [céphalopodes] capacité à éprouver de la douleur, de la souffrance, de la détresse et des dommages durables.[48] au Royaume-Uni, la législation sur la protection des animaux[49] signifie que les céphalopodes utilisés à des fins scientifiques doivent être tués sans cruauté, selon les méthodes prescrites (connues sous le nom d'«annexe 1 méthodes d'euthanasie") reconnues pour minimiser la souffrance.[50]
In medicine and research[edit]
Veterinary medicine[edit]
Veterinary medicine uses, for actual or potential animal pain, the same analgesics and anesthetics as used in humans.[51]
Dolorimetry[edit]
Dolorimetry (dolor: Latin: pain, grief) is the measurement of the pain response in animals, including humans. It is practiced occasionally in medicine, as a diagnostic tool, and is regularly used in research into the basic science of pain, and in testing the efficacy of analgesics. Non-human animal pain measurement techniques include the paw pressure test, tail flick test, hot plate test and grimace scales.
Laboratory animals[edit]
Animals are kept in laboratories for a wide range of reasons, some of which may involve pain, suffering or distress, whilst others (e.g. many of those involved in breeding) will not. The extent to which animal testing causes pain and suffering in laboratory animals is the subject of much debate.[52] Marian Stamp Dawkins defines "suffering" in laboratory animals as the experience of one of "a wide range of extremely unpleasant subjective (mental) states."[53] The U.S. National Research Council has published guidelines on the care and use of laboratory animals,[54] as well as a report on recognizing and alleviating pain in vertebrates.[55] The United States Department of Agriculture defines a "painful procedure" in an animal study as one that would "reasonably be expected to cause more than slight or momentary pain or distress in a human being to which that procedure was applied."[56] Some critics argue that, paradoxically, researchers raised in the era of increased awareness of animal welfare may be inclined to deny that animals are in pain simply because they do not want to see themselves as people who inflict it.[57] PETA however argues that there is no doubt about animals in laboratories being inflicted with pain.[58] In the UK, animal research likely to cause "pain, suffering, distress or lasting harm" is regulated by the Animals (Scientific Procedures) Act 1986 and research with the potential to cause pain is regulated by the Animal Welfare Act of 1966 in the US.
In the U.S., researchers are not required to provide laboratory animals with pain relief if the administration of such drugs would interfere with their experiment. Laboratory animal veterinarian Larry Carbone writes, “Without question, present public policy allows humans to cause laboratory animals unalleviated pain. The AWA, the Guide for the Care and Use of Laboratory Animals, and current Public Health Service policy all allow for the conduct of what are often called “Category E” studies – experiments in which animals are expected to undergo significant pain or distress that will be left untreated because treatments for pain would be expected to interfere with the experiment.”[59]
Severity scales[edit]
Eleven countries have national classification systems of pain and suffering experienced by animals used in research: Australia, Canada, Finland, Germany, The Republic of Ireland, The Netherlands, New Zealand, Poland, Sweden, Switzerland, and the UK. The US also has a mandated national scientific animal-use classification system, but it is markedly different from other countries in that it reports on whether pain-relieving drugs were required and/or used.[60] The first severity scales were implemented in 1986 by Finland and the UK. The number of severity categories ranges between 3 (Sweden and Finland) and 9 (Australia). In the UK, research projects are classified as "mild", "moderate", and "substantial" in terms of the suffering the researchers conducting the study say they may cause; a fourth category of "unclassified" means the animal was anesthetized and killed without recovering consciousness. It should be remembered that in the UK system, many research projects (e.g. transgenic breeding, feeding distasteful food) will require a license under the Animals (Scientific Procedures) Act 1986, but may cause little or no pain or suffering. In December 2001, 39 percent (1, 296) of project licenses in force were classified as "mild", 55 percent (1, 811) as "moderate", two percent (63) as "substantial", and 4 percent (139) as "unclassified".[61] In 2009, of the project licenses issued, 35 percent (187) were classified as "mild", 61 percent (330) as "moderate", 2 percent (13) as "severe" and 2 percent (11) as unclassified.[62]
In the US, the Guide for the Care and Use of Laboratory Animals defines the parameters for animal testing regulations. It states, "The ability to experience and respond to pain is widespread in the animal kingdom...Pain is a stressor and, if not relieved, can lead to unacceptable levels of stress and distress in animals. "[63] The Guide states that the ability to recognize the symptoms of pain in different species is essential for the people caring for and using animals. Accordingly, all issues of animal pain and distress, and their potential treatment with analgesia and anesthesia, are required regulatory issues for animal protocol approval.
See also[edit]
- Animal ethics
- Animal cognition
- Animal welfare
- Animal welfare science
- Bridge locus
- Animal consciousness
- Cruelty to animals
- Emotion in animals
- List of mutilatory procedures on animals
- Psychology of eating meat
- Moral status of animals in the ancient world
- Neural correlates of consciousness
- Philosophy of mind
- The Three Rs (animals)
References[edit]
- ^ IASP Pain Terminology
- ^ Andrew right, A Criticism of the IASP's Definition of Pain, http://www.academia.edu/1388768/A_Criticism_of_the_IASPs_Definition_of_Pain
- ^ Zimmerman M., (1986). Physiological mechanisms of pain and its treatment. Klinische Anaesthesiol Intensivether, 32:1–19
- ^ National Research Council (US) Committee on Recognition and Alleviation of Pain in Laboratory Animals (2009). "Recognition and Alleviation of Pain in Laboratory Animals". National Center for Biotechnology Information. Retrieved 14 February 2015.
- ^ a b Sneddon, L.U. (2004). "Evolution of nociception in vertebrates: comparative analysis of lower vertebrates". Brain Research Reviews. 46: 123–130. doi:10.1016/j.brainresrev.2004.07.007.
- ^ Price, T.J. & Dussor, G. (2014). "Evolution: the advantage of 'maladaptive'pain plasticity". Current Biology. 24 (10): R384–R386.
- ^ "Maladaptive pain". Oxford Reference. Retrieved 16 May 2016.
- ^ Crook, R.J., Dickson, K., Hanlon, R.T. and Walters, E.T. (2014). "Nociceptive sensitization reduces predation risk". Current Biology. 24 (10): 1121–1125.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ a b Sherwin, C.M. (2001). Can invertebrates suffer? Or, how robust is argument-by-analogy? Animal Welfare, 10(supplement): 103-118
- ^ Colpaert, F.C.; Tarayre, J.P.; Alliaga, M.; Slot, L.A.B.; Attal, N.; Koek, W. (2001). "Opiate self-administration as a measure of chronic nociceptive pain in arthritic rats". Pain. 91: 33–45. doi:10.1016/s0304-3959(00)00413-9.
- ^ Danbury, T.C., Weeks, C.A. Chambers, J.P., Waterman-Pearson, A.E. and Kestin. S.C. (2000). Self-selection of the analgesic drug carprofen by lame broiler chickens. Veterinary Record, 14:307-311
- ^ a b Carbone, Larry. '"What Animal Want: Expertise and Advocacy in Laboratory Animal Welfare Policy. Oxford University Press, 2004, p. 149.
- ^ a b The Ethics of research involving animals Nuffield Council on Bioethics, Accessed 27 February 2008 Archived 27 February 2008 at the Wayback Machine
- ^ Talking Point on the use of animals in scientific research, EMBO reports 8, 6, 2007, pp. 521–525
- ^ a b Rollin, Bernard. The Unheeded Cry: Animal Consciousness, Animal Pain, and Science. New York: Oxford University Press, 1989, pp. xii, 117-118, cited in Carbone 2004, p. 150.
- ^ Griffin, DR; Speck, GB (2004). "New evidence of animal consciousness" (PDF). Animal Cognition. 7 (1): 5–18. doi:10.1007/s10071-003-0203-x. PMID 14658059.
- ^ Allen C (1998). "Assessing animal cognition: ethological and philosophical perspectives" (PDF). J. Anim. Sci. 76 (1): 42–7. PMID 9464883.
- ^ Abbott FV, Franklin KB, Westbrook RF (January 1995). "The formalin test: scoring properties of the first and second phases of the pain response in rats". Pain. 60 (1): 91–102. doi:10.1016/0304-3959(94)00095-V. PMID 7715946.
- ^ a b c d Sneddon, Lynne. "Can animals feel pain?". PAIN. Retrieved 18 March 2012.
- ^ Elwood, R.W.; Barr, S.; Patterson, L. (2009). "Pain and stress in crustaceans?". Applied Animal Behaviour Science. 118 (3): 128–136. doi:10.1016/j.applanim.2009.02.018.
- ^ Rose JD, R Arlinghaus, SJ Cooke, BK Diggles, W Sawynok, ED Stevens and CDL Wynne (2012) "Can fish really feel pain?" Fish and Fisheries, 15 (1): 97–133. doi:10.1111/faf.12010
- ^ Snow P.J., Plenderleith M.B. and Wright L.L. (1993) "Quantitative study of primary sensory neurone populations of three species of elasmobranch fish." Journal of Comparative Neurology 334, pp. 97–103.
- ^ L.U. Sneddon; et al. "Do fishes have nociceptors? Evidence for the evolution of a vertebrate sensory system". National Center for Biotechnology Information. Retrieved 18 March 2012.
- ^ Sneddon L (2009). "Pain and Distress in Fish". ILAR J. 50 (4): 338–342. doi:10.1093/ilar.50.4.338.
- ^ Leake, J. (14 March 2004). "Anglers to Face RSPCA Check". The Sunday Times. Retrieved 15 September 2015.
- ^ Eisemann C, Jorgensen W, Rice D, Cribb M, Zalucki M, Merritt B, Webb P (1984). "Do insects feel pain? - A biological view" (PDF). Experentia. 40: 164–167. doi:10.1007/bf01963580.
- ^ "Do Invertebrates Feel Pain?", The Senate Standing Committee on Legal and Constitutional Affairs, The Parliament of Canada Web Site, accessed 11 June 2008.
- ^ Jane A. Smith (1991). "A question of pain in invertebrates". ILAR Journal. 33 (1–2).
- ^ Elwood, R.W., (2011). Pain and suffering in invertebrates? Institute of Laboratory Animal Resources Journal, 52(2): 175-84 [1]
- ^ Fiorito, G. (1986). "Is there pain in invertebrates?". Behavioural Processes. 12 (4): 383–388. doi:10.1016/0376-6357(86)90006-9.
- ^ St John Smith, E. and Lewin, G.R., (2009). Nociceptors: a phylogenetic view. Journal of Comparative Physiology A Neuroethology Sensory Neural and Behavioral Physiology, 195: 1089-1106
- ^ DeGrazia D, Rowan A (1991). "Pain, suffering, and anxiety in animals and humans". Theoretical Medicine and Bioethics. 12 (3): 193–211. doi:10.1007/BF00489606. PMID 1754965.
- ^ Lockwood JA (1987). "The moral standing of insects and the ethics of extinction". The Florida Entomologist. 70 (1): 70–89. doi:10.2307/3495093. JSTOR 3495093.
- ^ Eisemann C. H.; Jorgensen W. K.; Merritt D. J.; Rice M. J.; Cribb B. W.; Webb P. D.; Zalucki M. P. (1984). "Do insects feel pain? — A biological view". Experientia. 40: 164–7. doi:10.1007/bf01963580.
- ^ Tracey, J., W. Daniel, R. I. Wilson, G. Laurent, and S. Benzer. (2003). "painless, a Drosophila gene essential for nociception". Cell. 113 (2): 261–273. doi:10.1016/S0092-8674(03)00272-1. PMID 12705873.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Wittenburg, N.; Baumeister, R. (1999). "Thermal avoidance in Caenorhabditis elegans: an approach to the study of nociception". Proceedings of the National Academy of Sciences USA. 96: 10477–10482. doi:10.1073/pnas.96.18.10477.
- ^ Pryor, S.C., Nieto, F., Henry, S. and Sarfo, J. (2007). "The effect of opiates and opiate antagonists on heat latency response in the parasitic nematode Ascaris suum". Life Sciences. 80: 1650–1655. doi:10.1016/j.lfs.2007.01.011.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Dalton, L.M.; Widdowson, P.S. (1989). "The involvement of opioid peptides in stress-induced analgesia in the slug Arion ater". Peptides. 10: 9–13. doi:10.1016/0196-9781(89)90067-3.
- ^ Kavaliers, M.; Ossenkopp, K.-P. (1991). "Opioid systems and magnetic field effects in the land snail, Cepaea nemoralis". Biological Bulletin. 180: 301–309. doi:10.2307/1542401.
- ^ Dyakonova, V.E.; Schurmann, F.; Sakharov, D.A. (1999). "Effects of serotonergic and opioidergic drugs on escape behaviors and social status of male crickets". Naturwissenschaften. 86: 435–437. doi:10.1007/s001140050647.
- ^ Zabala, N.; Gomez, M. (1991). "Morphine analgesia, tolerance and addiction in the cricket, Pteronemobius". Pharmacology, Biochemistry and Behaviour. 40: 887–891. doi:10.1016/0091-3057(91)90102-8.
- ^ Lozada, M.; Romano, A.; Maldonado, H. (1988). "Effect of morphine and naloxone on a defensive response of the crab Chasmagnathus granulatus". Pharmacology, Biochemistry and Behavior. 30: 635–640. doi:10.1016/0091-3057(88)90076-7.
- ^ Maldonado, H.; Miralto, A. (1982). "Effects of morphine and naloxone on a defensive response of the mantis shrimp (Squilla mantis)". Journal of Comparative Physiology, A. 147: 455–459. doi:10.1007/bf00612010.
- ^ a b L. Sømme (2005). "Sentience and pain in invertebrates: Report to Norwegian Scientific Committee for Food Safety". Norwegian University of Life Sciences, Oslo.
- ^ Chittka, L.; Niven, J. (2009). "Are Bigger Brains Better?". Current Biology. 19 (21): R995–R1008. doi:10.1016/j.cub.2009.08.023. PMID 19922859.
- ^ Cephalopod brain size
- ^ Packard, A (1972). "Cephalopods and fish: the limits of convergence". Biological Reviews. 47: 241–307 [266–7]. doi:10.1111/j.1469-185X.1972.tb00975.x.
- ^ "Directive 2010/63/EU of the European Parliament and of the Council". Article 1, 3(b) (see page 276/39): Official Journal of the European Union. Retrieved 17 April 2016.
{{cite web}}: CS1 maint: location (link) - ^ "Animals (Scientific Protection) Act 1986". Retrieved 18 April 2016.
- ^ "The Animals (Scientific Procedures) Act 1986 Amendment Regulations 2012". Retrieved 15 April 2016.
- ^ Viñuela-Fernández I, Jones E, Welsh EM, Fleetwood-Walker SM (September 2007). "Pain mechanisms and their implication for the management of pain in farm and companion animals". Vet. J. 174 (2): 227–39. doi:10.1016/j.tvjl.2007.02.002. PMID 17553712.
- ^ Duncan IJ, Petherick JC. "The implications of cognitive processes for animal welfare", J. Anim. Sci, volume 69, issue 12, 1991, pp. 5017–22. PMID 1808195; Curtis SE, Stricklin WR. "The importance of animal cognition in agricultural animal production systems: an overview", J. Anim. Sci.. volume 69, issue 12, 1991, pp. 5001–7. PMID 1808193
- ^ Stamp Dawkins, Marian. "Scientific Basis for Assessing Suffering in Animals," in Singer, Peter. In Defense of Animals: The Second Wave. Blackwell, 2006. p. 28.
- ^ Committee for the Update of the Guide for the Care and Use of Laboratory Animals, ed. (2011). Guide for the Care and Use of Laboratory Animals (Report) (8th ed.). The National Academies Press.
- ^ National Research Council, Division on Earth and Life Studies, Committee on Recognition and Alleviation of Pain in Laboratory Animals (2009). Recognition and Alleviation of Pain in Laboratory Animals (PDF) (Report). The National Academies Press.
{{cite report}}: CS1 maint: multiple names: authors list (link) - ^ Animal Welfare; Definitions for and Reporting of Pain and Distress", Animal Welfare Information Center Bulletin, Summer 2000, Vol. 11 No. 1-2, United States Department of Agriculture.
- ^ Carbone 2004, p. 151.
- ^ http://www.peta.org/issues/animals-used-for-experimentation/animals-in-laboratories.aspx
- ^ Carbone, L (7 September 2011). "Pain in Laboratory Animals: The Ethical and Regulatory Imperatives". PLOS ONE. 6 (9): e21578. doi:10.1371/journal.pone.0021578. Retrieved 14 July 2015.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Fenwick, N.; Ormandy, E.; Gauthier, C.; Griffin, G. (2011). "Classifying the severity of scientific animal use: a review of international systems". Animal Welfare. 20: 281–301.
- ^ Ryder, Richard D. "Speciesism in the laboratory, " in Singer, Peter. In Defense of Animals: The Second Wave. Blackwell, 2006. p. 99.
- ^ "Home Office Statistics". Retrieved 31 October 2011.
- ^ Guide for the Care and Use of Laboratory Animals, ILAR, National Research Council, 1996 copyright, pg 64
Category:Animal welfare Category:Cruelty to animals Category:Pain


