User:Hysocc/SMKLMKimia10/TeoriAtom
Partikel penyusun atom[edit]
- Elektron, bermuatan negatif, muatan listrik -1.602 x 10-19 Coulomb, massa 9.1 x 10-28 gram
- Proton, bermuatan positif, muatan listrik +1.602 x 10-19 Coulomb, massa 1.67 x 10-24 gram
- Neutron, tidak bermuatan listrik, massa 1.67 x 10-24 gram
Perkembangan teori atom[edit]
- Teori atom Dalton
- Setiap zat tersusun atas partikel yang berukuran sangat kecil yang disebut dengan atom.
- Atom pada zat yang homogen bersifat identik dalam ukuran, massa, dan sifat lainnya. Atom dari unsur yang berbeda akan memiliki sifat yang berbeda pula.
- Atom tidak bisa dibagi, diciptakan, maupun dihancurkan. Secara tidak langsung, Dalton menyatakan tidak ada partikel subatomik seperti elektron, proton, dan neutron.
- Atom dari unsur yang berbeda dapat bergabung (bereaksi) dengan aturan rasio yang sederhana (hukum perbandingan berganda) untuk membentuk senyawa kimia.
- Dalam reaksi kimia, atom bergabung, berpisah, atau disusun ulang.
- Muncul setelah penemuan elektron dan inti atom.
- Elektron yang tersebar merata di dalam atom, dan proton berada pada pusat atom.
- Teori atom Rutherford

Perbandingan model teori atom Thomson dan Rutherford yang didapat dari eksperimen 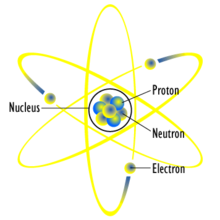
Lintasan elektron yang berbentuk elips
- Elektron mengelilingi inti atom dalam lintasan yang berbentuk elips.
- Inti atom terkonsentrasi di pusat atom dalam volume yang sangat kecil jika dibandingkan dengan diameter atom, namun menyumbang sebagian besar massa atom.
- Teori atom Bohr

Ilustrasi teori atom Bohr dengan elektron yang mengemisikan energi ketika berpindah lintasan
- Elektron bergerak mengelilingi inti dengan lintasan tertentu sehingga elektron berada pada tingkat energi tertentu pula.
- Elektron yang berpindah lintasan harus mengemisikan atau menyerap energi.
- Teori atom mekanika kuantum
- Posisi elektron di dalam atom tidak bisa ditentukan secara pasti, namun hanya dapat diperkirakan posisinya pada suatu jangkauan tertentu yang disebut dengan orbital.

Perpindahan energi atom[edit]
Elektron yang berpindah dari satu lintasan ke lintasan berikutnya akan mengalami perubahan tingkat energi sehingga menyebabkan atom mengemisikan energi atau menyerap energi. Perpindahan dari lintasan tinggi ke lintasan rendah akan menyebabkan atom mengemisikan energi, dan sebaliknya jika berpindah dari lintasan rendah ke lintasan tinggi harus menyerap energi. Energi yang diemisikan seringkali berbentuk cahaya. Konsep ini menjadi penyebab mengapa lampu dapat mengeluarkan cahaya.
Spektrum cahaya yang diemisikan bersifat unik bagi setiap unsur, dan sifat ini menjadi acuan untuk berbagai penerapan, seperti dalam bidang astronomi yaitu untuk menentukan unsur penyusun suatu bintang.
Energi yang diemisikan digambarkan dengan persamaan Rydberg:
di mana nf adalah bilangan kuantum akhir, dan ni adalah bilangan kuantum awal. Sedangkan RE adalah konstanta Rydberg yang memiliki nilai 2.178 x 10-18 Joule
Bilangan kuantum dan konfigurasi elektron[edit]
Dalam memperkirakan posisi suatu elektron dalam suatu unsur, digunakan koordinat yang terdiri dari empat bilangan kuantum, yaitu:
- Bilangan kuantum utama, dilambangkan dengan n
- Bilangan kuantum azimut, dilambangkan dengan l
- Bilangan kuantum magnetik, dilambangkan dengan m
- Bilangan kuantum spin, dilambangkan dengan s
Kombinasi dari semua bilangan kuantum tersebut menunjukkan jumlah maksimum elektron di setiap orbital dan kulit atom, seperti yang ditunjukkan pada table di bawah ini:
| n | l | m | Orbital | s | Jumlah maksimum elektron | |
|---|---|---|---|---|---|---|
| 1 | 0 | 0 | 1s | +½, -½ | 2 | 2 |
| 2 | 0 1 |
0 -1, 0, +1 |
2s 2p |
+½, -½ +½, -½ |
2 6 |
8 |
| 3 | 0 1 2 |
0 -1, 0, +1 -2, -1, 0, +1, +2 |
3s 3p 3d |
+½, -½ +½, -½ +½, -½ |
2 6 10 |
18 |
| 4 | 0 1 2 3 |
0 -1, 0, +1 -2, -1, 0, +1, +2 -3, -2, -1, 0, +1, +2, +3 |
4s 4p 4d 4f |
+½, -½ +½, -½ +½, -½ +½, -½ |
2 6 10 14 |
32 |
Sedangkan urutan untuk mengisi elektron mengikuti aturan Madelung seperti yang dijelaskan pada gambar di bawah ini.

Contoh, fosforus dengan nomor atom 15 akan memiliki konfigurasi elektron 1s2 2s2 2p6 3s2 3p3. Orbital 3p dapat memiliki elektron sampai enam, namun pada fosfor orbital p tidak penuh, hanya terisi tiga elektron saja. Sehingga orbital 3p hanya sampai 3p3. Pada orbital sebelum 3p, elektron mengisi penuh.
Jika suatu atom mengalami ionisasi (mengalami penambahan atau pengurangan elektron), maka cukup dengan menambah atau mengurangi elektron dari konfigurasi normalnya. Misal ion fosfor P3- akan memiliki konfigurasi elektron 1s2 2s2 2p6 3s2 3p6, dengan orbital terakhir mengalami penambahan elektron dari 3 menjadi 6.
Penulisan konfigurasi elektron dapat dipersingkat dengan menyisipkan gas mulia yang mengikutinya. Misal fosfor diikuti oleh gas mulia neon yang memiliki konfigurasi elektron 1s2 2s2 2p6, sehingga konfigurasi gas elektron cukup dituliskan dengan [Ne] 3s2 3p3. Penyingkatan harus dilakukan dengan gas mulia karena konfigurasi elektron yang mengikutinya adalah elektron valensi dari unsur tersebut. Pada fosfor, konfigurasi dari elektron valensinya adalah 3s2 3p3.
Namun aturan Madelung hanya berlaku untuk unsur sebelum Vanadium. Setelah Vanadium, beberapa unsur tidak mengikuti aturan Madelung, sehingga konfigurasi elektron tepatnya hanya bisa ditentukan melalui riset.
Hubungan tabel periodik dengan bilangan kuantum[edit]
Bilangan kuantum memiliki hubungan dengan tabel periodik karena jumlah dan posisi elektron valensi juga mempengaruhi sifat dari suatu unsur. Secara umum, hubungan tersebut diilustrasikan dengan gambar di bawah ini:

Unsur dengan elektron valensinya hanya berazimuth s akan mengisi golongan logam alkali dan logam alkali tanah. Elektron valensi berazimuth p akan mengisi metaloida, non-logam, halogen, dan gas mulia. Elektron valensi berazimuth d akan mengisi logam transisi. Sedangkan elektron valensi berazimuth f akan mengisi logam transisi dalam.





